- STÉRÉOCHIMIE - Stéréochimie inorganique
- STÉRÉOCHIMIE - Stéréochimie inorganiqueLa stéréochimie, qui concerne la structure spatiale d’une molécule, peut paraître plus complexe en chimie minérale qu’en chimie organique. Celle-ci est la chimie du carbone, élément petit qui s’entoure de deux, trois ou quatre autres éléments ou radicaux; l’entourage quatre correspond à la saturation électronique et à la structure tétraédrique. Par contre, avec les autres éléments qui représentent la plus grande partie du tableau de la classification périodique, on observe de deux à douze (ou plus) voisins autour de l’élément central.Depuis Alfred Werner (prix Nobel de chimie en 1913), le chimiste minéraliste a attaché de l’importance à la répartition des atomes dans l’espace. C’est avec les composés cinétiquement stables, c’est-à-dire cinétiquement inertes, comme les complexes octaédriques du cobalt III et plans du platine II, que les premiers chercheurs ont poussé le plus à fond leurs investigations. Grâce à la diffraction des rayons X, une confirmation définitive de la géométrie des molécules fut possible. Il a fallu attendre des théories comme celle du champ cristallin, celle du champ des coordinats pour lever quelques contradictions dans les premières relations trouvées entre un certain nombre de propriétés (magnétisme, coloration, etc.) et la structure proposée.1. Structure spatialePrincipales coordinencesLa théorie ionique simplifiée permet d’expliquer la formation de polyèdres de coordination. En supposant que les atomes soient des sphères non déformables, et que les ions de signes opposés soient en contact, on peut penser d’abord que la coordinence est déterminée par de simples considérations géométriques, cela malgré la charge et la nature des ions en présence. C’est ainsi que, dans le chlorure de sodium, l’ion Na+ est entouré de six ions Cl- alors que la charge est unique. Mais le rapport des rayons permettrait de concevoir douze ions Cl- autour de l’ion Na+. Partant du rapport 福 du rayon de l’atome central A au rayon de l’atome qui est coordiné, il est possible de prévoir des figures simples. Pour des valeurs de 福 comprises entre 0 et 0,155, on peut imaginer une structure linéaire. Pour des atomes répartis au sommet d’un triangle équilatéral, le rapport 福 est compris entre 0,155 et 0,225. Avec une coordinence 4 tétraédrique, on a 0,225 麗 福 麗 0,414. Mais si cette coordinence 4 correspond à un carré, la disposition est identique à celle d’un octaèdre avec 0,414 麗 福 麗 0,732. Pour des valeurs supérieures à 0,732 et inférieures à 1, l’atome ou l’ion, A, se situe au milieu d’un cube, si bien que, dans ce cas, à une formule donnée ne correspond pas la même coordinence. Dans un ion AB3n -, A n’est pas nécessairement entouré de trois B disposés au sommet d’un triangle équilatéral, mais A peut être au centre d’un octaèdre. L’exemple le plus simple est celui du chlorure de sodium dans lequel il n’existe qu’une seule charge négative (l’ion chlorure) avec une formule AB: chaque ion Cl- et chaque ion Na+ est lié à six voisins. Dans le chlorure de césium, l’ion césium est réuni à huit ions Cl-.Supposons que, dans l’ion AB4n -, A ne puisse s’entourer que de quatre voisins. L’examen du rapport des rayons permet d’envisager soit le carré, soit le tétraèdre. Des considérations de répulsions électrostatiques montrent que, si la liaison est ionique, c’est le tétraèdre qui offre la répulsion la plus efficace entre les ions de charges opposées, si bien que les écarts entre charges identiques sont les plus importants.Un modèle très courant est celui d’un composé de formule AB5. D’après la théorie ionique, le rapport des rayons est minimal et égal à 0,414 pour une bipyramide à base triangulaire (forme I) ou une pyramide à base carrée (forme II), mais cette limite de rapport est aussi celle de l’octaèdre.On peut dès lors envisager les trois géométries. Un composé pourra adopter plusieurs formes suivant l’état dans lequel il se trouve. Ainsi, on a proposé, à l’état gazeux, une forme monomère pour NbCl5, mais on observe une forme dinucléaire à l’état solide avec une coordinence 6 pour le niobium. On obtient des formes polynucléaires octaédriques avec Sb5. On retrouve souvent l’octaèdre qui correspond à une très bonne répulsion de B. Pour d’autres composés, le tétraèdre sera la structure la plus fréquente. Dans PBr5, on aura les ions PBr+4Br-; dans Cs3CoCl5, les anions présents seront CoCl2-4 et Cl-.Lorsque la coordinence 5 existe véritablement, on observe assez souvent le passage de la structure bipyramidale trigonale I à la structure bipyramidale à base carrée II. Cette conversion d’une structure à l’autre fait que deux atomes en position axiale dans le cas I peuvent revenir en position équatoriale (I ) après passage par la forme II (fig. 1).Quelquefois, la différence d’énergie entre deux structures est faible et il existe aussi des inversions, des pseudorotations. Le passage du plan carré au tétraèdre est observé pour le composé NiBr2L2 avec L = P(C6H5)2CH2C6H5.Lorsqu’il y a plusieurs atomes centraux, possibles, on a une chaîne. Par exemple, avec les ions S2-4, S22-7, S32-10, les premiers chaînons de tétraèdres sont liés par des ponts soufre-oxygène-soufre.Beaucoup d’exemples de coordinence supérieure à six peuvent être cités; sept avec U23-5 (bipyramide pentagonale) où les deux oxygènes sont en position axiale, huit avec K4Mo(CN)8 (dodécaèdre). Les lanthanides donnent des ions trivalents hydratés qui s’entourent de neuf molécules d’eau. Certaines molécules organiques captent des ions alcalins ou alcalino-terreux en donnant des coordinences élevées et en solubilisant les ions réputés insolubles avec certains anions. C’est ainsi que des molécules dénommées «cryptates» permettent la solubilisation du sulfate de baryum en captant l’ion Ba2+, même dans des solvants non aqueux.Essai de prédiction de structureLes considérations géométriques et la notion de liaison ionique peuvent être invoquées dans beaucoup de cas. Mais les liaisons ne sont pas toujours ioniques, si bien que d’autres géométries sont observées et elles s’écartent bien au-delà de ce que l’on pouvait prévoir. C’est ainsi que l’on constate que certains ions possèdent une coordinence préférée. Il est assez courant de voir le cuivre I s’entourer linéairement de deux ligands comme dans Cu(NH3)+2. Cette coordinence dépend aussi du coordinat qui viendra à côté de l’élément central; par exemple, la pyridine (py) servant de solvant viendra se lier à l’ion CoCl-3 pour donner l’ion pseudotétraédrique (CoCl3py)-, le ligand C- donnera des complexes plans avec le nickel (II): on a [Ni(CN)4]2-, tandis que Cl-, donnera des ions tétraédriques dans (CoCl4)2-.Sans développer les théories les plus modernes qui utilisent l’outil mathématique, on a proposé la structure préférée des ions des éléments de transition qui n’ont pas leur couche d complète. Il faut pour cela bien comprendre que les orbitales les plus importantes sont les orbitales d . Elles sont au nombre de cinq (dxy , dyz , dxz , d x 2–y 2, d z 2) et ont la même énergie si l’ion est isolé ou s’il est dans un champ sphérique. Mais lorsqu’on approche des coordinats, le champ produit provoque une séparation de ces orbitales. Certaines sont stabilisées du point de vue énergétique par rapport à d’autres (cf. COORDINATION [chimie] – Composés de coordination). Dans un octaèdre, le groupe d xy dyz dxz , appelé t 2g , est stabilisé par rapport au groupe e g qui représente les deux autres. En tenant compte de l’énergie de stabilisation correspondante pour le champ des coordinats (exprimé en cm-1), on calcule en première approximation, suivant le nombre d’électrons d dans la configuration électronique, quelle géométrie sera préférable. On obtient ainsi le tableau 1.On constate ainsi que l’entourage octaédrique est très probable avec le nickel (II) de configuration d 8.Par contre, si l’on considère un champ fort, le même calcul (tabl. 2) montre qu’avec le nickel (II) c’est la géométrie plane qui est favorisée. Cela explique la formation de Ni(CN)2-4 plan carré.2. IsomérieOn appelle isomères les molécules ou les ions qui ont la même formule brute mais des arrangements différents de leurs atomes. Cette définition restreinte peut être élargie. C’est ainsi qu’en chimie minérale, on désigne par isomérie électronique une isomérie qui ne concerne pas l’arrangement des atomes, mais une répartition différente des électrons dans les orbitales. Il est bien entendu que les composés ont toujours la même composition chimique.Si une même substance peut exister sous plusieurs formes cristallines, ce ne sont pas toujours des isomères. L’exemple le plus simple est celui du soufre qui cristallise dans le système monoclinique ou dans le système orthorhombique suivant les conditions opératoires. Les cristaux contiennent dans les deux cas des cycles de surface non plane avec huit atomes de soufre.Isomérie géométriqueDeux isomères géométriques se distinguent par une répartition différente des atomes dans l’espace autour de l’élément central. Si les coordinats sont proches, on dira qu’ils sont en position cis ; s’ils sont opposés, ils sont en position trans. Cette isomérie n’a jamais été rencontrée avec le tétraèdre pour des raisons géométriques, mais elle existe avec de nombreuses coordinences. Nous l’examinerons dans le cas du plan et de l’octaèdre.Cas du planLes composés plans se rencontrent principalement avec la configuration électronique d 8. Les exemples les plus couramment rencontrés le sont effectivement avec le nickel (II), le platine (II), le palladium (II), le rhodium (I), l’iridium (I), l’or (III). Parmi ceux-ci, c’est le platine (II) qui a été le plus étudié. Pour un composé plan Mabcd , où les lettres a , b , c , d représentent des coordinats, il y a trois sortes d’isomères géométriques (fig. 2).On peut prévoir la synthèse de ces deux isomères en considérant ce qu’on appelle l’effet trans . Si l’on part de l’ion PtCl42-, par réaction avec NH3 on obtient une première substitution sur l’un quelconque des quatre sommets avec formation de l’ion (PtCl3NH3)-.Puis l’effet trans du ligand Cl- étant plus important que celui du ligand NH3, la deuxième substitution se fera en position trans par rapport au ligand Cl-; on a la réaction 1.Si l’on part de l’ion [Pt(NH3)4]2+, on obtient dans une première substitution l’ion PtCl(NH3)3+. La deuxième substitution se fera en trans par rapport au ligand Cl- (réaction 2).Les ligands peuvent être classés en tenant compte de l’effet trans :
 Cet effet est le plus important avec le coordinat C-.Cas de l’octaèdreDans le cas de l’octaèdre les isomères géométriques connus sont très nombreux. Ils présentent des colorations différentes avec les ions des éléments de transition. Citons l’exemple du cation de cobalt (III) [CoCl2(NH3)4]+, devenu classique depuis Werner (réaction 3).En tenant compte du théorème de Polya (cf. J. Sala-Pala et J.-É. Guerchais, 1969), on calcule le nombre d’isomères géométriques et de paires d’énantiomères. Pour un octaèdre, on obtient le tableau 3.Remarquons que, si deux isomères géométriques sont théoriquement prévus pour une formule Ma 2b 4, il y a des cas où seule l’une des formes est observée comme (OsO2X4)2- (forme trans ) et (MoO2X4)2- (forme cis ). Avec X, coordinat monodenté négatif, les formes préférentielles s’expliquent par le recouvrement des orbitales d du molybdène et de l’osmium avec les orbitales p size=1神 de l’oxygène. La formation de liaison à caractère 神 fait que les liaisons avec l’oxygène sont fortes et courtes. On constate que l’ordre de la liaison y est plus important en comparant les relations entre les distances de l’ion métallique à l’oxygène, les constantes de forces et l’ordre des liaisons.Isomérie optiquePar définition, deux isomères qui ont la propriété de faire tourner le plan de polarisation de la lumière soit à droite (dextro, d ) soit à gauche (lévo, l ) sont dits optiquement actifs. De telles molécules ne possèdent pas de centre de symétrie, de plan de symétrie ni d’axe alterne, c’est-à-dire d’axe correspondant à une rotation suivie d’une opération de symétrie par rapport à un plan. Examinons plusieurs géométries.Le tétraèdreLe cas du tétraèdre est très connu en chimie organique avec le carbone. Le vocabulaire employé est aussi le même. En chimie minérale, sa géométrie a été mise en évidence avec le phosphore et l’étain principalement, mais elle le sera ou l’est déjà avec l’aluminium, le cobalt, l’arsenic, le chrome, le manganèse, le fer, le zinc, etc.Les coordinats peuvent être bidentates, c’est-à-dire avoir deux sites de liaisons; c’est ainsi (fig. 4) qu’ont été isolés les énantiomères du bis(benzoylacétonato) béryllium (II).L’octaèdreDans le cas d’un tétraèdre, il faut que tous les coordinats monodentés situés autour de l’atome nucléaire soient différents pour obtenir une paire d’énantiomères; on a ce qu’on appelle un élément asymétrique. Quand il s’agit d’un octaèdre cela n’est pas nécessaire. Aux formules Ma 2b 2c 2, Ma 3bcd , Ma 2b 2cd , Ma 2bcde correspondent respectivement 1, 1, 2, 6 paires d’énantiomères (cf. STÉRÉOCHIMIE – Stéréochimie organique) sans compter tous les isomères géométriques (tabl. 3). Dans le cas où tous les coordinats sont différents, Mabcdef , il y a théoriquement quinze paires d’énantiomères. Cela ne se rencontre pas souvent, mais on peut citer le composé PtClBrI(NO2)(NH3)(NC6H5). L’octaèdre est très courant et le nombre de combinaisons est important. Les mécanismes et les processus d’isomérisation sont très étudiés.C’est parmi les chélates qu’on connaît le plus d’exemples expérimentaux. Soit le tris-oxalatocobaltate (III) de potassium K3[Co(C24)3], qui existe sous forme de cristaux individuels de chacun des énantiomères. Il est possible de les séparer mécaniquement à la pince puisqu’ils cristallisent séparément. Les transformations sont si lentes que le composé racémique dit inerte est dédoublable. Il n’en serait pas de même des composés contenant l’anion Al(C24)2-3, par exemple; cette espèce est dite labile .Prenant toujours le même anion pour obtenir d [Co(C24)3]3- à partir du sel de potassium, on utilise un agent cationique, l’ion l [Ni(phen)3]2+ en solution alcoolique. Ce dernier est un ion complexe, stable et asymétrique. Le mélange va provoquer la précipitation du composé Kl [Ni(phen)3] d [Co(C24)3]. En traitant le précipité recueilli par l’eau oxygénée et l’iodure de potassium, on récupère K3d [Co(C24)3]. Comment expliquer cela? Les énantiomères ont des propriétés physiques identiques, mais ils se comportent différemment en présence d’une substance optiquement active. Par réaction du composé racémique avec une substance active, on a formation de diastéréo-isomères et non pas d’énantiomères. Il est alors possible de faire une séparation par une méthode physique: séparation par chromatographie, cristallisation, précipitation. Les agents de résolution, en l’occurrence le cation Ni(phen)32+, peuvent être les mêmes que ceux utilisés en chimie organique (tartrate, strychnine).Des adsorbats sont utilisables. L’amidon est un adsorbant asymétrique; ses groupements hydroxylés permettent une réaction avec certains groupements polaires des complexes. L’une des formes 見Co(glycine)3 est éluée plus facilement que l’autre.Autres coordinencesOn observe l’activité optique pour d’autres coordinences, par exemple 8, avec V(C24)4-4, Zr(C24)4-4, mais les géométries sont nombreuses et on envisage de nombreux cas suivant qu’on est en présence d’un cube, d’un antiprisme ou d’un dodécaèdre. Il est à remarquer qu’un composé peut avoir des propriétés optiques si le coordinat organique lié à l’ion métallique possède ces propriétés.Isomérisation de liaisonsSi un coordinat est ambidentate, c’est-à-dire s’il a plusieurs sites de liaisons, il pourra se lier à l’atome de plusieurs façons. L’exemple le plus connu est celui de Sophus Mads Jørgensen; il prépara, en 1894, deux isomères du composé [Co2(NH3)5] Cl2; il émit l’hypothèse que la forme rouge contenait le groupement «nitrito», ce qui veut dire que le cobalt trivalent était lié par un oxygène Co 漣ONO, et que la forme jaune contenait le groupement «nitro», le cobalt trivalent étant lié cette fois par l’azote Co 漣2. La nomenclature permet de différencier les deux isomères, on dira «nitro» et «nitrito». De même, on a le coordinat «thiocyanato» lorsque la liaison se fait par le soufre du groupe NCS, et «isothiocyanato» si c’est par l’azote du même groupement.Beaucoup de ligands peuvent former les isomères de liaison, par exemple C-, S2-3, NCS-, NCSe-, le diméthylsulfoxyde, les thioamides.Un équilibre tel que:
Cet effet est le plus important avec le coordinat C-.Cas de l’octaèdreDans le cas de l’octaèdre les isomères géométriques connus sont très nombreux. Ils présentent des colorations différentes avec les ions des éléments de transition. Citons l’exemple du cation de cobalt (III) [CoCl2(NH3)4]+, devenu classique depuis Werner (réaction 3).En tenant compte du théorème de Polya (cf. J. Sala-Pala et J.-É. Guerchais, 1969), on calcule le nombre d’isomères géométriques et de paires d’énantiomères. Pour un octaèdre, on obtient le tableau 3.Remarquons que, si deux isomères géométriques sont théoriquement prévus pour une formule Ma 2b 4, il y a des cas où seule l’une des formes est observée comme (OsO2X4)2- (forme trans ) et (MoO2X4)2- (forme cis ). Avec X, coordinat monodenté négatif, les formes préférentielles s’expliquent par le recouvrement des orbitales d du molybdène et de l’osmium avec les orbitales p size=1神 de l’oxygène. La formation de liaison à caractère 神 fait que les liaisons avec l’oxygène sont fortes et courtes. On constate que l’ordre de la liaison y est plus important en comparant les relations entre les distances de l’ion métallique à l’oxygène, les constantes de forces et l’ordre des liaisons.Isomérie optiquePar définition, deux isomères qui ont la propriété de faire tourner le plan de polarisation de la lumière soit à droite (dextro, d ) soit à gauche (lévo, l ) sont dits optiquement actifs. De telles molécules ne possèdent pas de centre de symétrie, de plan de symétrie ni d’axe alterne, c’est-à-dire d’axe correspondant à une rotation suivie d’une opération de symétrie par rapport à un plan. Examinons plusieurs géométries.Le tétraèdreLe cas du tétraèdre est très connu en chimie organique avec le carbone. Le vocabulaire employé est aussi le même. En chimie minérale, sa géométrie a été mise en évidence avec le phosphore et l’étain principalement, mais elle le sera ou l’est déjà avec l’aluminium, le cobalt, l’arsenic, le chrome, le manganèse, le fer, le zinc, etc.Les coordinats peuvent être bidentates, c’est-à-dire avoir deux sites de liaisons; c’est ainsi (fig. 4) qu’ont été isolés les énantiomères du bis(benzoylacétonato) béryllium (II).L’octaèdreDans le cas d’un tétraèdre, il faut que tous les coordinats monodentés situés autour de l’atome nucléaire soient différents pour obtenir une paire d’énantiomères; on a ce qu’on appelle un élément asymétrique. Quand il s’agit d’un octaèdre cela n’est pas nécessaire. Aux formules Ma 2b 2c 2, Ma 3bcd , Ma 2b 2cd , Ma 2bcde correspondent respectivement 1, 1, 2, 6 paires d’énantiomères (cf. STÉRÉOCHIMIE – Stéréochimie organique) sans compter tous les isomères géométriques (tabl. 3). Dans le cas où tous les coordinats sont différents, Mabcdef , il y a théoriquement quinze paires d’énantiomères. Cela ne se rencontre pas souvent, mais on peut citer le composé PtClBrI(NO2)(NH3)(NC6H5). L’octaèdre est très courant et le nombre de combinaisons est important. Les mécanismes et les processus d’isomérisation sont très étudiés.C’est parmi les chélates qu’on connaît le plus d’exemples expérimentaux. Soit le tris-oxalatocobaltate (III) de potassium K3[Co(C24)3], qui existe sous forme de cristaux individuels de chacun des énantiomères. Il est possible de les séparer mécaniquement à la pince puisqu’ils cristallisent séparément. Les transformations sont si lentes que le composé racémique dit inerte est dédoublable. Il n’en serait pas de même des composés contenant l’anion Al(C24)2-3, par exemple; cette espèce est dite labile .Prenant toujours le même anion pour obtenir d [Co(C24)3]3- à partir du sel de potassium, on utilise un agent cationique, l’ion l [Ni(phen)3]2+ en solution alcoolique. Ce dernier est un ion complexe, stable et asymétrique. Le mélange va provoquer la précipitation du composé Kl [Ni(phen)3] d [Co(C24)3]. En traitant le précipité recueilli par l’eau oxygénée et l’iodure de potassium, on récupère K3d [Co(C24)3]. Comment expliquer cela? Les énantiomères ont des propriétés physiques identiques, mais ils se comportent différemment en présence d’une substance optiquement active. Par réaction du composé racémique avec une substance active, on a formation de diastéréo-isomères et non pas d’énantiomères. Il est alors possible de faire une séparation par une méthode physique: séparation par chromatographie, cristallisation, précipitation. Les agents de résolution, en l’occurrence le cation Ni(phen)32+, peuvent être les mêmes que ceux utilisés en chimie organique (tartrate, strychnine).Des adsorbats sont utilisables. L’amidon est un adsorbant asymétrique; ses groupements hydroxylés permettent une réaction avec certains groupements polaires des complexes. L’une des formes 見Co(glycine)3 est éluée plus facilement que l’autre.Autres coordinencesOn observe l’activité optique pour d’autres coordinences, par exemple 8, avec V(C24)4-4, Zr(C24)4-4, mais les géométries sont nombreuses et on envisage de nombreux cas suivant qu’on est en présence d’un cube, d’un antiprisme ou d’un dodécaèdre. Il est à remarquer qu’un composé peut avoir des propriétés optiques si le coordinat organique lié à l’ion métallique possède ces propriétés.Isomérisation de liaisonsSi un coordinat est ambidentate, c’est-à-dire s’il a plusieurs sites de liaisons, il pourra se lier à l’atome de plusieurs façons. L’exemple le plus connu est celui de Sophus Mads Jørgensen; il prépara, en 1894, deux isomères du composé [Co2(NH3)5] Cl2; il émit l’hypothèse que la forme rouge contenait le groupement «nitrito», ce qui veut dire que le cobalt trivalent était lié par un oxygène Co 漣ONO, et que la forme jaune contenait le groupement «nitro», le cobalt trivalent étant lié cette fois par l’azote Co 漣2. La nomenclature permet de différencier les deux isomères, on dira «nitro» et «nitrito». De même, on a le coordinat «thiocyanato» lorsque la liaison se fait par le soufre du groupe NCS, et «isothiocyanato» si c’est par l’azote du même groupement.Beaucoup de ligands peuvent former les isomères de liaison, par exemple C-, S2-3, NCS-, NCSe-, le diméthylsulfoxyde, les thioamides.Un équilibre tel que: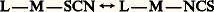 subit les effets électroniques du ligand L.Pour un atome central M donné, on peut n’observer qu’une seule forme, c’est-à-dire qu’il n’y a pas apparition d’isomère, comme dans le cas de l’isomérie géométrique. Par exemple, on a Cr(NCS)3-6 (1) et Hg(SCN)2-4 (2), alors que d’autres atomes nucléaires M présenteront les deux formes M 漣NCS et M 漣SCN. Cela peut être relié à la classification de S. Ahrland, J. Chatt et N. R. Davies (1958), qui rangent les ions métalliques en deux classes «a » et «b », et à celle de R. G. Pearson (1963), qui proposa un système acide-base pris dans une très large acception. Pearson énonce la règle suivante, connue sous le nom de principe de symbiose : les acides durs, qui correspondent aussi aux ions métalliques de la classe «a » (les ions des métaux électropositifs) comme Cr3+, préfèrent s’associer aux bases dures comme N, O et F et les acides mous aux bases molles (P, S, I). Ces acides durs forment les complexes les plus stables avec le premier atome du ligand de chacun des groupes suivants dans l’ordre de stabilité décroissante:
subit les effets électroniques du ligand L.Pour un atome central M donné, on peut n’observer qu’une seule forme, c’est-à-dire qu’il n’y a pas apparition d’isomère, comme dans le cas de l’isomérie géométrique. Par exemple, on a Cr(NCS)3-6 (1) et Hg(SCN)2-4 (2), alors que d’autres atomes nucléaires M présenteront les deux formes M 漣NCS et M 漣SCN. Cela peut être relié à la classification de S. Ahrland, J. Chatt et N. R. Davies (1958), qui rangent les ions métalliques en deux classes «a » et «b », et à celle de R. G. Pearson (1963), qui proposa un système acide-base pris dans une très large acception. Pearson énonce la règle suivante, connue sous le nom de principe de symbiose : les acides durs, qui correspondent aussi aux ions métalliques de la classe «a » (les ions des métaux électropositifs) comme Cr3+, préfèrent s’associer aux bases dures comme N, O et F et les acides mous aux bases molles (P, S, I). Ces acides durs forment les complexes les plus stables avec le premier atome du ligand de chacun des groupes suivants dans l’ordre de stabilité décroissante: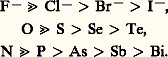 Leur rayon ionique est petit, leur degré d’oxydation élevé et leur polarisabilité faible; ils se lient fortement avec des bases qui donnent de fortes liaisons avec le proton, et de préférence en donnant une liaison ionique. On explique ainsi l’exemple (1) de Cr(NCS)3-6.Les cations métalliques de la classe «b », ou acides mous, comme Hg2+, forment des complexes stables, de préférence covalents, avec des atomes de ligands, en tenant compte d’un ordre de stabilité inverse de celui donné précédemment. On voit donc que le soufre se lie de préférence au mercure (II), comme dans l’exemple (2), Hg(SCN)2-4.Pour chaque coordinat ambidentate, certains acides se situent à la frontière entre les deux classes. Dans cette limite, on aura ainsi de fortes chances de rencontrer des isomères de liaison, bien que les autres coordinats non ambidentates présents dans le composé puissent avoir une influence sur la liaison considérée.Isomérie d’ionisationÀ l’isomérie d’ionisation correspondent des complexes qui ont même composition mais dont les ions sont différents en solution. Citons, avec le platine (IV):
Leur rayon ionique est petit, leur degré d’oxydation élevé et leur polarisabilité faible; ils se lient fortement avec des bases qui donnent de fortes liaisons avec le proton, et de préférence en donnant une liaison ionique. On explique ainsi l’exemple (1) de Cr(NCS)3-6.Les cations métalliques de la classe «b », ou acides mous, comme Hg2+, forment des complexes stables, de préférence covalents, avec des atomes de ligands, en tenant compte d’un ordre de stabilité inverse de celui donné précédemment. On voit donc que le soufre se lie de préférence au mercure (II), comme dans l’exemple (2), Hg(SCN)2-4.Pour chaque coordinat ambidentate, certains acides se situent à la frontière entre les deux classes. Dans cette limite, on aura ainsi de fortes chances de rencontrer des isomères de liaison, bien que les autres coordinats non ambidentates présents dans le composé puissent avoir une influence sur la liaison considérée.Isomérie d’ionisationÀ l’isomérie d’ionisation correspondent des complexes qui ont même composition mais dont les ions sont différents en solution. Citons, avec le platine (IV):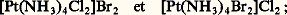 avec le cobalt (III):
avec le cobalt (III):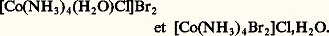 Isomérie d’hydratationDans les isomères d’hydratation le nombre de molécules d’eau est le même, mais le nombre de liaisons des molécules d’eau avec l’élément central est différent. Cette isomérie peut se rapprocher de l’isomérie d’ionisation (cf. supra ). Suivant des préparations précises, on peut, par exemple, obtenir trois composés hydratés du chrome (III) de même formule brute. L’isomère I, [Cr(H2O)6]Cl3, possède quatre ions en solution; l’isomère II, [Cr(H2O)5Cl]Cl2, H2O, de coloration vert-bleu, en possède trois. Les mesures de conductivité sur l’isomère III, qui est le produit commercial, vert sombre, [Cr(H2O)4Cl2]Cl, 2H2O, permettent de déduire qu’il n’y a que deux ions. En solution, la forme III se transforme assez rapidement en la forme II. Le dosage des ions Cl- peut être effectué à partir d’une solution de nitrate mercurique en présence de nitroprussiate comme indicateur. On pourrait aussi envisager deux isomères géométriques pour la forme III.Isomérie de polymérisationBien que n’étant pas des isomères à proprement parler, puisqu’ils n’ont pas les mêmes représentations spatiales, les isomères de polymérisation sont classés ainsi parce qu’ils ont la même composition globale. Citons:
Isomérie d’hydratationDans les isomères d’hydratation le nombre de molécules d’eau est le même, mais le nombre de liaisons des molécules d’eau avec l’élément central est différent. Cette isomérie peut se rapprocher de l’isomérie d’ionisation (cf. supra ). Suivant des préparations précises, on peut, par exemple, obtenir trois composés hydratés du chrome (III) de même formule brute. L’isomère I, [Cr(H2O)6]Cl3, possède quatre ions en solution; l’isomère II, [Cr(H2O)5Cl]Cl2, H2O, de coloration vert-bleu, en possède trois. Les mesures de conductivité sur l’isomère III, qui est le produit commercial, vert sombre, [Cr(H2O)4Cl2]Cl, 2H2O, permettent de déduire qu’il n’y a que deux ions. En solution, la forme III se transforme assez rapidement en la forme II. Le dosage des ions Cl- peut être effectué à partir d’une solution de nitrate mercurique en présence de nitroprussiate comme indicateur. On pourrait aussi envisager deux isomères géométriques pour la forme III.Isomérie de polymérisationBien que n’étant pas des isomères à proprement parler, puisqu’ils n’ont pas les mêmes représentations spatiales, les isomères de polymérisation sont classés ainsi parce qu’ils ont la même composition globale. Citons: Dans ce cas, le monomère peut avoir deux isomères géométriques (tabl. 3), CoCl2(py )2 monomère pseudotétraédrique et CoCl2(py )2 polymère octaédrique. La forme bleue pseudotétraédrique monomère de ce dernier complexe se transforme assez rapidement à l’état solide en forme rose. Le composé ZnCl2(py )2 monomère est stable; il suffit de l’incorporer dans le réseau du composé du cobalt pour stabiliser la forme bleue.Isomérie électroniqueLes isomères électroniques sont des composés qui présentent un comportement magnétique anormal. Ils sont soit «à spin faible», soit «à spin élevé». La configuration de l’ion métallique est en d 4, d 5, d 6, d 7 pour un octaèdre régulier, ou en d 8 pour un octaèdre déformé. Par exemple, pour le fer (III), de configuration d 5, dans le composé Fe(S2CNR2)3, on a, soit un système à spin faible avec un électron non apparié dans l’orbitale t2g (t52g ), soit un système à spin élevé avec cinq électrons non appariés (t32g eg 2).Isomérie cristallineLes édifices de taille finie, comme ceux dont nous venons de parler, ne sont pas les seuls à présenter le phénomène d’isomérie. Ce dernier se rencontre aussi dans certains cristaux lorsque les atomes s’enroulent suivant des hélices qui peuvent être droites ou gauches , le cristal étant alors optiquement actif. Par exemple: le quartz (pour la structure, cf. SILICATES) ou encore le cinabre HgS, dont la structure dérive de celle de NaCl, et où les ions Hg2+ se rapprochent pour former des paires se disposant avec les ions S2- suivant des hélices. Certaines argiles (kaolinites) présentent aussi une légère activité optique, d’où l’idée qu’elles peuvent avoir joué un rôle dans les synthèses asymétriques des molécules organiques lors de l’apparition de la vie sur Terre.
Dans ce cas, le monomère peut avoir deux isomères géométriques (tabl. 3), CoCl2(py )2 monomère pseudotétraédrique et CoCl2(py )2 polymère octaédrique. La forme bleue pseudotétraédrique monomère de ce dernier complexe se transforme assez rapidement à l’état solide en forme rose. Le composé ZnCl2(py )2 monomère est stable; il suffit de l’incorporer dans le réseau du composé du cobalt pour stabiliser la forme bleue.Isomérie électroniqueLes isomères électroniques sont des composés qui présentent un comportement magnétique anormal. Ils sont soit «à spin faible», soit «à spin élevé». La configuration de l’ion métallique est en d 4, d 5, d 6, d 7 pour un octaèdre régulier, ou en d 8 pour un octaèdre déformé. Par exemple, pour le fer (III), de configuration d 5, dans le composé Fe(S2CNR2)3, on a, soit un système à spin faible avec un électron non apparié dans l’orbitale t2g (t52g ), soit un système à spin élevé avec cinq électrons non appariés (t32g eg 2).Isomérie cristallineLes édifices de taille finie, comme ceux dont nous venons de parler, ne sont pas les seuls à présenter le phénomène d’isomérie. Ce dernier se rencontre aussi dans certains cristaux lorsque les atomes s’enroulent suivant des hélices qui peuvent être droites ou gauches , le cristal étant alors optiquement actif. Par exemple: le quartz (pour la structure, cf. SILICATES) ou encore le cinabre HgS, dont la structure dérive de celle de NaCl, et où les ions Hg2+ se rapprochent pour former des paires se disposant avec les ions S2- suivant des hélices. Certaines argiles (kaolinites) présentent aussi une légère activité optique, d’où l’idée qu’elles peuvent avoir joué un rôle dans les synthèses asymétriques des molécules organiques lors de l’apparition de la vie sur Terre.
Encyclopédie Universelle. 2012.
